Terpeny są głównymi składnikami olejków eterycznych i odpowiadają za właściwości zapachowe konopi. Wraz z kannabinoidami, terpeny ilustrują efekt synergii i/lub entourage, a ich interakcje były spekulowane dopiero od kilkudziesięciu lat. Zidentyfikowano setki terpenów, które nawiązują do cech sensorycznych konopi, przyczyniając się w dużej mierze do doświadczeń konsumentów i ceny rynkowej. Wzmacniają również wiele korzyści terapeutycznych, zwłaszcza jako aromaterapia. Aby rzucić światło na znaczenie terpenów w przemyśle konopi, celem tego przeglądu jest morfologiczne opisanie źródeł terpenów z konopi oraz wyjaśnienie biosyntezy i różnorodności profili terpenowych w różnych chemovarach konopi.
1. Wstęp
Cannabis sativa L. lub konopie indyjskie to roślina jednoroczna, która ma długą historię stosowania na całym świecie jako błonnik, żywność, olej, a także w medycynie. W zależności od celu użytkowania można je nazywać różnymi nazwami; na przykład „konopie” jako uprawa włókien i tekstyliów oraz „konopie rekreacyjne” lub znane w USA jako marihuana. Oprócz jakości tkaniny przemysłowej, właściwości psychoaktywne oznaczały szare piętno roślin konopi jako nielegalny narkotyk pod wieloma nieformalnymi nazwami, w tym trawą, trawą, trawą, Mary Jane, pączkiem, haszem, bhang, kef, gandżą , locoweed, reefer, doob, spliff, toke i roach. W wielu krajach uprawa została zabroniona ze względu na zawarte w niej składniki psychoaktywne [ 1]. W sensie medycznym, wiele ostatnich badań doradzało, że wzrost używania konopi miał związek z objawami psychiatrycznymi, w tym depresją i lękiem [ 2 , 3 ]. Jednak wielu użytkowników nadal popiera wyłącznie jego rekreacyjny cel [ 4 , 5 ]. W rezultacie nastąpił silny ruch w kierunku korygowania negatywnych postaw wobec konopi i podjęto próby usunięcia tej rośliny z list narkotyków. Na przykład w Tajlandii od 2020 r. szczepy konopi, takie jak กัญชง (konopie) i กัญชา (marihuana) są legalnie uprawiane do celów przemysłowych lub leczniczych na kontrolowanym poziomie aktywnych metabolitów, w tym kannabinoidów Δ9–tetrahydrokannabinolu (THC) i kanabidiol (CBD) [ 6]. Podczas gdy uwaga skupiła się głównie na bioaktywnych funkcjach kannabinoidów, terpeny węglowodorowe mogą również oferować interesujące efekty otoczenia, które mogłyby idealnie synergizować lub podążać za ich skutkami [ 7 ]. Wybitnie, wraz z rozwojem legalnego przemysłu konopnego, zainteresowano się terpenami z konopi indyjskich, ponieważ przyczyniają się one do wielu różnych właściwości aromatycznych, które wpływają na różne odmiany szczepów konopi [ 8].]. W ramach tego przeglądu przedstawiamy ogólną historię odkrycia konopi indyjskich i znaczenie terpenów. Omówiono taksonomię i morfologię konopi, w szczególności lokalizację terpenów. Co ważniejsze, chemia, biosynteza i różnorodność terpenów w różnych genotypach konopi są przedmiotem dużego zainteresowania w tym przeglądzie.
2. Odkrycie konopi i ich znaczenie jako źródła terpenu
Konopie indyjskie mają długą historię, sięgającą mniej więcej tuż po epoce lodowcowej, ponieważ w historycznych jaskiniach w Czechach znaleziono strzępy sznurków i tekstyliów z włókien konopi [ 9 , 10 ]. W XIX wieku roślina ta została odnotowana jako pochodząca z południowego obszaru Morza Kaspijskiego w pobliżu Iranu ( ryc. 1b) [ 11 , 12 ]. Zostało to później potwierdzone przez chemotaksonomię olejku eterycznego z konopi różnego pochodzenia, a większość fenotypów konopi zebranych na całym świecie miała składniki chemiczne podobne do tych pochodzących z Azji Środkowej [ 13 ]. W poprzednich dniach była znana jako oryginalna roślina włóknista w kulturze azjatyckiej. Ekstrakty z nasion i oleju z nasion były również używane jako żywność [11 , 14 ]. Pierwsze wzmianki o marihuanie w literaturze w Chinach można datować na około 5000 lat temu, co zostało napisane przez cesarza Chen Nonga, który był wówczas znany jako ojciec chińskiego rolnictwa. Chiński alfabet „Ma” został stworzony na wzór procesu suszenia konopi ( Rysunek 1a ). Litera została dostosowana do opisania rośliny męskiej, „jego” oddzielonej od rośliny żeńskiej, „chu” dla jakości włókna [ 15 , 16 ]. W 500 p.n.e. używanie konopi rozprzestrzeniło się na całym świecie jedwabnym szlakiem z Azji do Europy i Afryki. W XIX wieku konopie były popularne w świecie zachodnim jako roślina włóknista o doskonałych właściwościach [ 17 , 18]. Nie jest więc zaskakujące, że konopie indyjskie są dziś znane jako roślina idealna pod względem zrównoważonego rozwoju. W okresie szybkiego rozwoju przemysłowego konopie stały się uprawą przemysłową, gdy kraje ścigały się ze sobą w kierunku nowoczesności. Oprócz światowego przemysłu tekstylnego zakład zaczął być znany z problemów medycznych. Wierzono, że w XIX wieku dostępne były tysiące leków z konopi indyjskich, produkowanych przez ponad 280 producentów [ 19 ]. Wzrost i zainteresowanie tą rośliną włóknistą załamały się po próbie dodania jej do listy narkotyków z opium podczas konwencji genewskiej w 1925 r. [ 19 ].
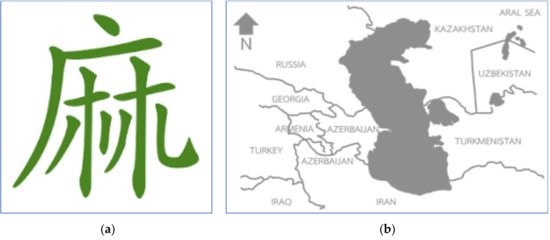
Rysunek 1. Ewolucja chińskich znaków słowa „ Cannabis sativa ” lub „Ma” ( a ) oraz miejsce pochodzenia rośliny konopi w południowym Morzu Kaspijskim w pobliżu Iranu ( b ).Pierwsze izolaty kannabinoidów stosowane do celów leczniczych znajdowały się w Czechosłowacji, a CBD po raz pierwszy w pełni scharakteryzowano w 1963 r., a następnie psychoaktywne THC w następnym roku [ 20 , 21 , 22 ]. Odkrycie receptorów kannabinoidowych CB1 i CB2 wraz z pełnym zrozumieniem układu endokannabinoidowego pomogło nam rozpoznać lecznicze właściwości tej rośliny [ 23 , 24 ]. W 1942 r. Simonsen i Todd [ 25 ] byli pierwszymi badaczami, którzy umieścili frakcje terpenowe jako odrębną kategorię od kannabinoidów i p-cymen był głównym składnikiem egipskiego haszyszu. Dopiero w ostatnich latach chemicy na całym świecie spekulowali na temat synergii i/lub efektu otoczenia innych związków konopi, w tym terpenów [ 26 ]. Została po raz pierwszy opisana jako drogi molekularnej regulacji aktywności endogennych kannabinoidów [ 27 ]. Russo [ 28 ] udokumentował wyjątkowe działanie terapeutyczne terpenów z konopi, które prawdopodobnie odgrywały rolę w efektach otoczenia właściwości leczniczych kannabinoidów. Ta synergia fitokannabinoidów i terpenoidów może poprawić leczenie bólu, stanów zapalnych, depresji, lęku, uzależnień, epilepsji, raka, infekcji grzybiczych i bakteryjnych [ 7 , 28 ,29,30,31].
3. Taksonomia i lokalizacja konopi terpenowych
Konopie indyjskie należą do małej rodziny Cannabaceae, która obejmuje chmiel i jagody Celtis. Jest to roślina dwuliścienna okrytozalążkowa, która daje niepełne (brak płatków) i również niedoskonałe typy kwiatów z wydzielonymi narządami płciowymi. Kwiat nosi tylko słupki, znane jako kwiaty słupkowe (lub kwiaty żeńskie), a te z samymi pręcikami nazywane są pręcikami (lub kwiatami męskimi). W naturze konopie wytwarzają kwiaty męskie lub żeńskie (dwupienne), jednak w warunkach krótkiego dnia mogą dawać kwiaty zarówno męskie, jak i żeńskie lub jednopienne. Rośliny mogą rosnąć do 3 m lub mniej w zależności od odmiany i warunków wzrostu. Kwiaty często zaczynają się jako grupy kwiatów lub pąki pachowe ( ryc. 2a,b). Łodyga składa się z najbardziej zewnętrznej warstwy naskórka, która jest cienka i gruba, oraz z warstw pierwotnych i wtórnych, które zapewniają lepszą jakość włókien. Najbardziej wewnętrzne, czyli zdrewniałe wtórne włókno dmuchowe, daje najlepszą jakość włókien [ 32 , 33 ].

Rysunek 2. Roślina konopi var. Kees’ Old School Haze ® (dostępne na https://dutch-passion.com ) ( a ) i ich pąki kwiatowe var. Klej Gorilla Glue (dostępny na http://www.seedstockers.com ) ( b ).Liście palmatowe z 5–7 listkami. Kwiat męski ( Rysunek 3a ) nie ma płatków, zwykle z pięcioma żółtawymi działkami, a pięć pylników daje pyłek. Kwiat żeński ( Rysunek 3b) miał pojedynczą owulację i został wzbogacony o struktury włosków, które są lokalizacją kannabinoidów i terpenów, jak pokazano na Rysunku 3c. Te terpeny są odpowiedzialne za obronę i interakcję z roślinożercami i szkodnikami.

Rysunek 3. kwiaty konopi pręcikowa ( ) i kwiaty słupki ( b ) ze strukturami włosków jak lokalizacja kanabinoidów i terpenów Kees’ Old School Haze ® (dostępny w https://dutch-passion.com ) ( c ) .
Taksonomowie we wczesnych dniach podzielili rośliny konopi na trzy gatunki: (i) C. sativa Linnaeus, (ii) C. indica Lamarck i (iii) C. ruderalis [ 34 , 35 ]. Obecnie wielu badaczy jest przekonanych, że konopie uprawiane komercyjnie to C. sativa L, ale pododmiana „sativa” powinna być znana jako konopie, a pododmiana „Indica” powinna być nazywana rekreacyjną marihuaną lub marihuaną. Różnice w tych pododmianach przedstawia tabela 1. Użyteczną częścią konopi jest w szczególności łodyga, podczas gdy części zwykle z włoskami są częściami użytkowymi dla konopi. Poziom THC jest oceniany jako >2% suchej masy, a kwiaty dają znacznie wyższą zawartość terpenów, które stają się lepkie w dotyku [ 36 ]. Niektórzy badacze nie zgadzają się z oddzieleniem ich składem chemicznym. Morfologicznie liść konopi jest szerszy, a kolor ciemniejszy w porównaniu z konopiami. Wiele ostatnich badań próbowało oddzielić kombinację składu terpenowego w kilku gatunkach Cannabaceae, gdzie widać, że konopie i konopie Indica są blisko spokrewnione. Na przykład konopie mogą również wytwarzać profile terpenowe podobne do tych z marihuany [ 37 ].
Tabela 1. Różnice między konopiami (marihuaną) a konopiami.
| Characteristics | Cannabis (Marijuana) | Hemp |
|---|---|---|
| Genus | Cannabis sativa L. | Cannabis sativa L. |
| Sub variety | Indica | sativa |
| Utilized organs | leaves, flowers, stems and seeds containing trichomes | stem |
| Level of psychoactive THC | High (>1%/DW) | Low |
| Medicinal CBD | Can be high | Can be high |
| Leaf | Broad, darker leaf color | Thinner and greenish |
| Content of terpene (Rosin) | High (gluey) | Low |
Na podstawie morfologii powierzchni scharakteryzowano trzy typy włosków gruczołowych: bulwiaste, siedzące i szypułkowe ( ryc. 4 a) [ 38 ]. Włośniki bulwiaste są najmniejsze, natomiast bezszypułkowe pojawiają się na naskórku z krótką szypułką i kulistą główką złożoną z wielokomórkowego krążka komórek wydzielniczych i podnaskórkowej jamy magazynującej metabolity. Podobnie, trichomy szypułkowe są nieco większe, a kulista głowa uniesiona ponad powierzchnię naskórka przez wielokomórkową łodygę [ 39 ]. W konopiach włosie bezszypułkowe i szypułkowe różnią się nie tylko morfologią, ale mają również odmienne właściwości fluorescencyjne, liczbę komórek w dysku wydzielniczym i profile terpenowe [ 40].]. Włośniki gruczołowe z łodygami dojrzałych kwiatów mają kulistą główkę składającą się z powiększonego dysku większego niż osiem komórek wydzielniczych, o których wiadomo, że są bogate w kannabinoidy i monoterpeny ( Rysunek 4b). Osadzone trichomy znajdują się głównie na liściach cukru ( Rysunek 4 c). Mają osiem komórek wydzielniczych, które wytwarzają mniej kannabinoidów i większe proporcje seskwiterpenów.
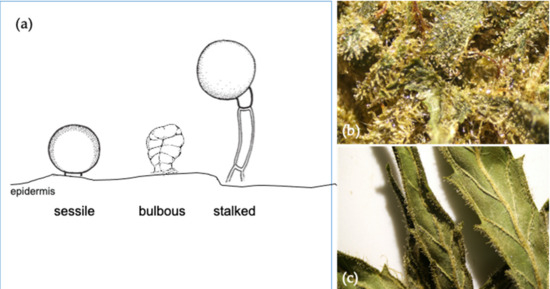
Rysunek 4. Różne struktury trichomów dla roślin konopi ( a ); typy szypułkowe, które są dostępne na powierzchni kwiatowej ( b ); oraz struktury liści cukrowych z obecnością włosków Cannabis sativa L. var. Kees’ Old School Haze ® (dostępny w https://dutch-passion.com ) ( c ).W celu oddzielenia trichomów kwiaty są zwykle wstępnie zamrażane lub liofilizowane, a następnie delikatnie wcierane w siatkę sita. Trichomy oddzielone w tym procesie są znane jako kief, który można sprasować w celu uzyskania haszyszu. W Nepalu haszysz jest ręcznie formowany w kulki, znane również jako wosk lub „Charas” [ 41 ]. Z drugiej strony olej haszyszowy to skoncentrowany haszysz, który został rozpuszczony w rozpuszczalnikach organicznych, takich jak alkohol, propan lub butan [ 42 , 43 ]. Ekstrakcja pozwala na ekstrakcję pigmentów, takich jak chlorofile i inne zanieczyszczenia, wraz z terpenami, co daje ciemnozielony ekstrakt. Po ekstrakcji rozpuszczalnik jest następnie usuwany przez odparowanie przez bezpośrednie ogrzewanie lub pod próżnią, w wyniku czego powstaje produkt olejowy o wysokiej lepkości.
4. Biosynteza terpenów w konopiach
Energia wymagana do wzrostu i rozwoju roślin pochodzi z fotosyntezy, oddychania i transpiracji z O 2 , CO 2 , składnikami odżywczymi i wodą. Energia jest odzyskiwana w postaci pierwotnych składników chemicznych, które później wykorzystują rośliny. Te podstawowe metabolity obejmują węglowodany, lipidy, białka i kwasy nukleinowe. Jednak podczas cykli wzrostu i reprodukcji rośliny mogą być narażone na stres, w tym trudne warunki środowiskowe lub szkodniki i zwierzęta roślinożerne. Rośliny wytwarzają następnie różne grupy związków zwanych metabolitami wtórnymi, które są wykorzystywane jako obrona przed tymi wyzwaniami. Na przykład może wytwarzać związki, które przyciągają owady zapylające, w tym ptaki, aby pomóc im w procesie zapłodnienia lub dyspersji nasion [ 44].]. Związki te są produkowane w różnych formach i są wykorzystywane ze względu na ich funkcje biologiczne [ 45 ]; na przykład alkaloidy, takie jak morfina i kodeina w opium, dają ssakom działanie psychoaktywne i przeciwbólowe. Fenole i flawonoidy znajdujące się w skórce owoców i jagód mają działanie przeciwutleniające [ 46 ]. Związki zawierające siarkę, takie jak allicyna w czosnku, mogą być stosowane do redukcji lipoglicerydów we krwi, a także mają zdolność pobudzania apetytu [ 47 ]. Glikozyd saponinowy w orzechach mydlanych może być stosowany jako środek powierzchniowo czynny [ 48 ] i wreszcie terpenoidy, które są głównymi składnikami występującymi w roślinach zawierających olejki eteryczne [ 49 ]], są stosowane jako dodatki do żywności, a niektóre przedstawiają psychoaktywne zdolności i cechy zapachowe, takie jak te występujące w konopiach. Terpeny to węglowodory z małymi jednostkami izoprenowymi połączonymi ze sobą w celu utworzenia łańcuchów, podczas gdy terpenoidy to terpeny zawierające tlen. W konopiach zwykle występują trzy rodzaje terpenów/terpenoidów, które są (i) monoterpenami (10C) złożonymi z dwóch jednostek izoprenowych; (ii) seskwiterpeny (15C) trzech izoprenów; (iii) diterpeny (20C) czterech izoprenów; oraz (iv) triterpeny (30C) sześciu izoprenów [ 26 ]. Do tej pory zgłoszono ponad 200 substancji lotnych z różnych genotypów konopi, z których scharakteryzowano 58 monoterpenów i 38 seskwiterpenów [ 50 , 51 , 52 , 53 ].Rycina 5a ilustruje chromatogram ekstraktu terpenowego z tkanki kwiatowej konopi. Między innymi głównymi składnikami monoterpenowymi są limonen, β-myrcen, α-pinen i linalol ze śladowymi ilościami α-terpinolenu i tran-ocimenu [ 54 , 55 ] ( Rysunek 5b), podczas gdy dominującymi seskwiterpenami są E- kariofilen, kariofilen tlenek, E -β-farnezen i β-kariofilen [ 56 ]. Kannabinoidy są biologicznie syntetyzowane ze struktur diterpenowych, tworząc fenoloterpenoidy, które stanowią prawie jedną czwartą wszystkich metabolitów [ 26 ]. W ten sposób połączenie terpenów zapewnia wyjątkowe aromaty różnym szczepom.
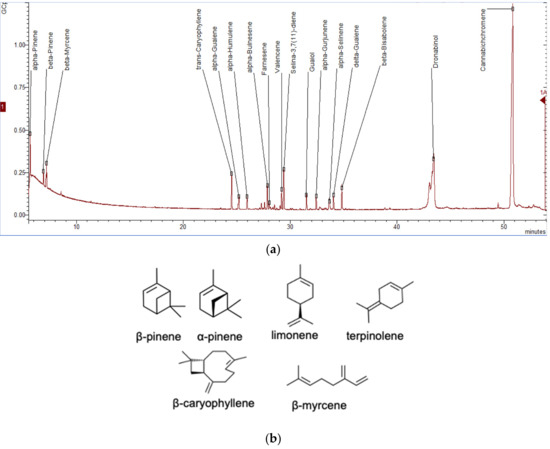
Rysunek 5. Chromatogram gazowy ekstraktu terpenowego z konopi (butanol) z tkanki kwiatowej Cannabis sativa L. ( a ) i dominujących chemovarów terpenowych ( b ) wyposażony w spektrometrię masową (GC-MS ). Oznacza wysuszony kwiat konopi (0,2 g) wyekstrahowany propanolem metodą wspomaganą ultradźwiękami [ 36 ], a analizę metodą spektrometrii masowej (GC-MS) metodą chromatografii gazowej przeprowadzono zgodnie z protokołem opisanym wcześniej [ 57 ].Biosynteza tych drugorzędowych metabolitów terpenów rozpoczyna się od powszechnych izoprenoidowych prekursorów difosforanowych (5C) dwoma ścieżkami, szlakiem plastydowego fosforanu metyloerytrytolu (MEP) i szlakiem cytozolowego mewalonianu (MEV) [ 8 , 58 ]. Te szlaki regulują różne substraty dostępne do syntezy terpenów (TPS). MEP przekształca pirogronian i gliceraldehydo-3-fosforan (G3P) w 5-węglowe bloki budulcowe, difosforan izopentylu (IPP) i difosforan dimetyloallilu (DMAPP) w plastydach [ 59].]. Z drugiej strony szlak MEV zmienia trzy jednostki acetylo-CoA w IPP, który jest następnie izomeryzowany do DMAPP przez izomerazę IPP w cytozolu. IPP i DMAPP są skondensowane do izoprenoidowych difosforanów o dłuższym łańcuchu, które obejmują difosforan geranylu (GPP) i difosforan farnezylu (FPP) [ 58 ]. Te liniowe difosforany izoprenoidu są substratami odpowiednio dla syntaz monoterpenowych (mono-TPS) i seskwiterpenowych (seskwi-TPS), które różnicują te prekursory poprzez modyfikacje enzymatyczne, takie jak hydroksylacja, odwodornienie, acylacja i glikozylacja na różne zakresy mono- i seskwiterpeny [ 59 , 60 ]. GPP jest również budulcem biosyntezy kannabinoidów ( Rysunek 6 ) [ 61 ].
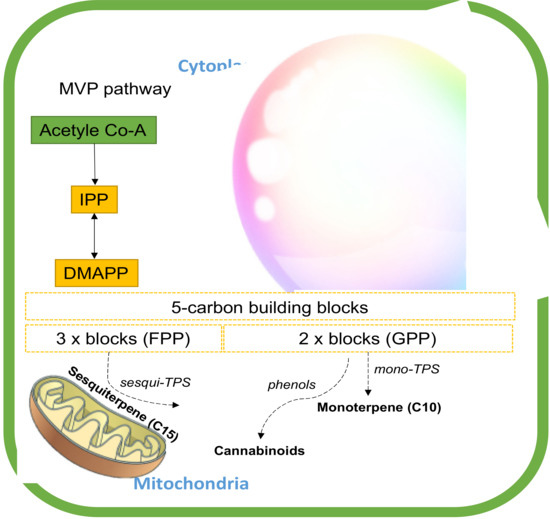
Rysunek 6. Ścieżka biosyntezy terpenów w konopiach. Skróty: DMPP, difosforan dimetyloallilu; FPP, difosforan farnezylu; IPP, difosforan izopentenylu; GPP, difosforan geranylu; mono-TPS, syntaza monoterpenowa; sesqui-TPS, syntaza seskwiterpenowa.Szlak biosyntezy kannabinoidów obejmuje proces chemicznego łączenia fenolu z terpenami w nieaktywne formy kwasowe, które w dużej mierze determinują ich moc i właściwości farmaceutyczne, w tym kannabichromen (CBC), kwas kannabidiolowy (CBDA), kannabigerol (CBG) kannabinol ( CBN), kannabidiwaryna (CBDV), kwas kannabidiwarinowy (CBDVA), kwas kannabigerolowy (CBGA), kannabicyklol (CBL), delta 8 – THC, kwas tetrahydrokannabinolowy (THCA) i tetrahydrokannabiwaryna (THCV) [ 62 ]. Związki te, wraz z terpenami, są wytwarzane w strukturach trichomów występujących na żeńskim kwiecie konopi [ 40]. Najwyższe stężenie naturalnych kannabinoidów w konopiach to kwas kannabidiolowy (CBDA) i kwas Δ9-tetrahydrokannabinowy (Δ9-THCA). Psychoaktywne metabolity, takie jak delta 9-THC i niepsychoaktywne CBD, są następnie aktywowane poprzez dekarboksylację za pomocą obróbki cieplnej. Sprzyja temu również kilka czynników, takich jak czas przechowywania i stosowanie warunków alkalicznych [ 63 , 64 ]. Poniżej znajdują się ważne grupy terpenów z konopi oraz ich synergiczne i funkcjonalne właściwości.
4.1. Konopie indyjskie Monoterpen
α-pinen i β-pinen hamują aktywność acetylocholinesterazy w mózgu. Dlatego twierdzi się, że wspomaga pamięć i minimalizuje dysfunkcje poznawcze wywołane zatruciem THC [ 65 ]. Charakterystyczny zapach sosny ma działanie antyseptyczne [ 49 , 66 , 67 ]. Wiadomo, że β-mircen ma działanie przeciwbólowe THC i CBD poprzez stymulację uwalniania endogennych opioidów poprzez mechanizm zależny od receptora α2-adrenergicznego [ 68 , 69 ]. Tak więc, jeśli poziom mircenu jest >0,5%, może to skutkować efektem „blokady kanapy”, podczas gdy niski poziom mircenu (>0,5% mircenu) może wytworzyć wyższą energię [ 26]. Związek ten oferuje piżmowy lub chmielowy zapach z funkcjami przeciwutleniającymi i przeciwrakotwórczymi [ 28 , 66 ]. Chociaż postulowano, że limonen o zapachu cytrusowym ma niskie powinowactwo do receptorów kannabinoidowych, ten monoterpen zwiększa poziom serotoniny i dopaminy, wywołując tym samym przeciwlękowe, antystresowe i uspokajające działanie CBD [ 68 , 70 ]. Kwiatowy zapach linalolu może pomóc w złagodzeniu lęku poprzez aromaterapię [ 66 ].
4.2. Seskwiterpeny z konopi
β-kariofilen, aromat przyprawowy (pieprzowy), jest najbardziej dostępnym seskwiterpenoidem w roślinach i ekstraktach konopi, zwłaszcza po dekarboksylacji pod wpływem ciepła. Jest agonistą receptora CB2 bez psychoaktywności [ 52 ]. Odpowiada również za działanie przeciwzapalne konopi [ 66 ]. Udowodniono również, że ten seskwiterpen ma działanie gastroprotekcyjne, przeciwbólowe, przeciwnowotworowe, przeciwgrzybicze, przeciwbakteryjne, przeciwdepresyjne, przeciwzapalne, przeciwproliferacyjne, przeciwutleniające, przeciwlękowe, przeciwbólowe i neuroprotekcyjne [ 26 ]. Udowodniono, że tlenek kariofilenu, który nadaje zapach podobny do melisy, ma właściwości przeciwgrzybicze i owadobójcze [ 28 ].
5. Konopne Chemovary
W zależności od różnych składów terpenów, różne „odmiany” konopi wywołują różne aromaty z większym powiązaniem z jakością produktu, ceną detaliczną i preferencjami konsumentów [ 8 , 71 ]. Kompozycje terpenowe konopi są zmienną sezonową. Zmiany w proporcji terpenoidów w konopiach zależą od odmiany konopi, części rośliny, warunków środowiskowych, dojrzałości i metody analiz [ 72 , 73 , 74 ]. Różne etapy wzrostu konopi mogą dawać znaczne różnice w składzie terpenów. Uznano, że profil terpenowy konopi w fazie wegetatywnej ma znacznie niższy udział monoterpenów niż w fazie kwitnienia [ 56]. Oprócz zmienności i składu terpenów wśród różnych fenotypów, modulowane funkcje molekularne lub biologiczne terpenów są skuteczne tylko wtedy, gdy stężenie terpenów w ekstrakcie z konopi o pełnym spektrum wynosi powyżej 0,05% v/w [ 31 , 68 , 75 ]. Aby scharakteryzować profil aromatyczny konopi różnych chemovarów, do zebrania substancji lotnych z próbek wykorzystano nieniszczącą i nieinwazyjną metodę mikroekstrakcji do fazy stałej (SPME) [ 53 , 76 ]. Metoda ta faworyzuje małą wielkość próbki, eliminuje stosowanie rozpuszczalników organicznych, a co ważniejsze, pozwala na emisję setek związków lotnych z próbek [ 53 ,77 ]. Rysunek 7 przedstawia chromatogramy lotnych związków dyfundujących z tkanki kwiatowej C. sativa var. Northern Light przy użyciu SPME i chromatografii gazowej. Wykryto aż 51 substancji lotnych, w których dominował kariofilen, podczas gdy β-mircen i limonen należały do głównych zidentyfikowanych monoterpenów.
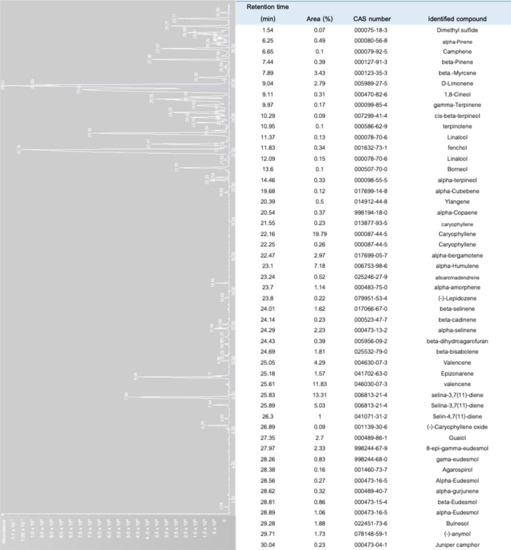
Rysunek 7. Chromatogram profili lotnych Cannabis sativar L. var. Zorza polarna ( https://www.seedstockers.com ). Oznacza terpeny wyizolowane z suszonej florescencji (50 mg) za pomocą mikroekstrakcji fazy stałej (SPME) nad roztworem do fazy stałej za pomocą 50/30 μm karbowaksu-diwinylobenzenu, włókna CAR-PDMS-DVB StableFlex (Supelco, Bellefonte, PA, USA), a następnie chromatografii gazowej sprzężonej z masą spektrometria [ 75 , 78 ].Wśród szczepów konopi analizowanych przez Shapirę, Bermana, Futorana, Gubermana i Meiri [ 75 ] wyróżniono pięć grup chemotypów według dominujących terpenów: (i) β-mircen, (ii) α- i β-pinen, (iii) β-kariofilen i limonen, (iv) β-kariofilen i (v) terpinolen. W percepcji sensorycznej różnic w profilu terpenowym między szczepami konopi wyznaczono dwie odrębne opisowe grupy grupujące [ 71 ]. Pierwsza grupa obejmowała jednolicie ziemiste, drzewne i ziołowe, a druga grupa składała się z najczęstszych deskryptorów, takich jak cytrusowy, cytrynowy, słodki i ostry. Tabela 2 przedstawia listy szczepów konopi dostępnych w holenderskiej firmie zajmującej się nasionami pasji ( https://dutch-passion.com) sklasyfikowane według chemotypów i kategorii opisowych.
Tabela 2. Kategoria profilu terpenowego różnych komercyjnych plam konopi.
| Cannabis Family (commercial)* | Stains (Commercial Names) | Seed Types | Level of Cannabinoid THC (Max = 5) | Chemotypic Catagories 1 | Descriptive Sensorial Categories 1 | |||||
| (i) β-myrcene | (ii) α- and β-pinene | (iii) β-caryophyllene and Limonene | (iv) β-caryophyllene | (v) Terpinolene | (i) Earthy, Woody and Herbal | (ii) Citrus, Lemon, Sweet and Pungent | ||||
| Afghani Kush | Banana Blaze® | F | 3 |  | ||||||
| Auto Banana Blaze® | F, A | 5 |  | |||||||
| Master Kush | F | 3 |  | |||||||
| Night Queen® | F | 4 |  | |||||||
| Blue family | Auto Blue Berry® | F, A | 3 |  | ||||||
| Auto Black Berry Kush® | F, A | 4 |  | |||||||
| Blue Auto Mazar® | F, A | 4 |  |  | ||||||
| CBD rich | CBD Charlotte’s Angel® | F | 1 |  |  | |||||
| CBD Skunk Haze® | F | 2 |  |  | ||||||
| Classics | C-vibez® | F | 5 |  | ||||||
| Mokum’s Tulip® | F | 4 |  | |||||||
| Auto Ultimate® | F, A | 4 |  |  | ||||||
| Think Fast® | F | 3 |  | |||||||
| Auto Cinderella Jack® | F, A | 5 |  |  | ||||||
| Outlaw Amnesia® | F | 4 |  |  | ||||||
| Auto Xtreme® | F, A | 4 |  |  | ||||||
| Auto White Widow® | F, A | 4 |  |  | ||||||
| Dutch outdoor | Frisian Dew® | F | 2 |  |  | |||||
| Purple N0. 1® | R, F | 2 |  |  | ||||||
| Auto Durban Poison® | F, A | 2 |  |  | ||||||
| High altitude | Snow Bud® | F | 2 |  |  | |||||
| Orange family | Passion Fruit® | F | 4 |  |  | |||||
| US special | Sugar Bomb Punch® | F | 5 |  |  | |||||
| Kerosene Krash® | F | 5 |  | |||||||
| Meringue® | F | 5 |  | |||||||
| Hifi 4G® | F | 4 |  |  | ||||||
| Auto lemon Kix® | F, A | 5 |  |  | ||||||
| Bubba island Kush® | F | 4 |  | |||||||
| Auto Glueberry O.G.® | F, A | 4 |  |  |
1 The chemotype categories as described by Shapira, Berman, Futoran, Guberman, and Meiri [75] and the descriptive sensory group according to Gilbert and DiVerdi [71]. F = Feminized; A = Auto; R = Regular, * available at https://dutch-passion.com. The odor representatives;  hop;
hop;  pine;
pine;  lime;
lime;  spice and
spice and  orange peel were according to Russo [28].
orange peel were according to Russo [28].
6. Oddzielenie terpenów konopi od znaczenia przemysłowego
W przeszłości identyfikacja profilu terpenowego konopi miała na celu ulepszenie pomocy szkoleniowych psów w wykrywaniu nielegalnych narkotyków [ 76 ]. Jednak w świecie przemysłu konopnego terpeny odgrywają istotną rolę w różnicowaniu smaku i aromatu, które są specyficzne dla poszczególnych szczepów [ 56 ]. Niektóre terpeny mogą wzmacniać działanie kannabinoidów i synergizować uczucie relaksu, łagodzenia stresu, zwiększania energii i utrzymywania koncentracji wraz z ich podstawowymi funkcjami farmaceutycznymi [ 54 , 79]. W związku z tym rosnąca liczba branż wykazała zainteresowanie dodawaniem terpenów z konopi indyjskich lub terpenów pochodzenia botanicznego do swoich olejów CBD i artykułów spożywczych. Szacowany wzrost w tym sektorze powinien osiągnąć 20 miliardów rynku do 2024 roku [ 80 , 81 ]. Sukces w tym sektorze może być podważony kilkoma ograniczeniami. Po pierwsze, konsument uważa, że funkcjonalność i bezpieczeństwo są rzeczywiście związane ze źródłami, postrzeganą nowością, a co najważniejsze, postrzeganymi korzyściami [ 82 , 83 ]. Ponadto ekstrakcja oleju o pełnym spektrum, składającego się z pełnej mieszanki naturalnie występujących terpenów z konopi, jest prawie niemożliwa. Najbardziej opłacalnym sposobem jest selektywne oddzielenie terpenów i włączenie ich z powrotem do produktów końcowych [68,80].Opracowano liczne techniki odzyskiwania terpenów oparte na rozpuszczalniku lub bez rozpuszczalnika. Olejki eteryczne to zazwyczaj hydrodestylowane ekstrakty z włosków konopi zawierające głównie terpeny lub terpenoidy. Chociaż większość składników pozostaje nienaruszona podczas destylacji, kilka monoterpenów może ulegać przemianom chemicznym lub dość często jest traconych ze względu na charakter procesu destylacji [ 26 , 56 ]. Inną możliwą techniką jest destylacja z parą wodną poprzez przepuszczanie suchej pary przez kwiatostany konopi, w której terpeny ulatniają się, kondensują i zbierają [ 84 , 85]. Ponadto ekstrakcja wspomagana mikrofalami (MAE) może wzbogacić związki bioaktywne. Obróbka MAE z użyciem dużej mocy napromieniowania i stosunkowo długich czasów ekstrakcji znacząco zwiększyła zawartość CBD w olejku eterycznym ze znacznie wysoką wydajnością w porównaniu z konwencjonalnymi technikami hydrodestylacji [ 86 ]. Na przykład w Kanadzie komercyjną produkcję ekstraktu osiąga się przez ekstrakcję rozpuszczalnikiem, takim jak butan lub płyn nadkrytyczny (SFE), z ograniczeniem czystości produktu bez zanieczyszczeń rozpuszczalnikowych [ 87 ]. Wiadomo, że ta późniejsza technika zapewnia lepszą wydajność w odzyskiwaniu terpenów [ 88]. SFE stał się ostatnio znacznie preferowaną metodą odzyskiwania terpenów, głównie dlatego, że pozwala na stosowanie niższych temperatur, co prowadzi do mniejszego degradacji składników nietrwałych termicznie i jest wolny od rozpuszczalników organicznych [ 88 , 89 ]. Płyn nadkrytyczny to substancja o temperaturze i ciśnieniu powyżej jej punktów krytycznych, bez granicy między fazą ciekłą i gazową. W tych punktach płyn ma niską lepkość i wysokie właściwości dyfuzyjne, aby rozpuszczać cząsteczki chemiczne z macierzy roślinnej. Dwutlenek węgla (CO 2) jest powszechnie stosowany, ponieważ jest niepalny, stosunkowo niedrogi i nietoksyczny. Dzięki tej metodzie odzyskano duże ilości składników terpenowych (tj. można odzyskać odpowiednio do 50%, 20% i 10% kariofilenu, humulenu i limonenu w porównaniu z metodami konwencjonalnymi) [ 64 , 89 ].
7. Wnioski
Rekreacyjna marihuana jako składnik żywności stała się bardziej akceptowalna w szerszym kontekście publicznym, w którym terpeny z konopi zyskały w ostatnich latach dużą uwagę przemysłową. Profile terpenowe nie tylko ucieleśniają cechy genotypów konopi, ale ich działanie na otoczenie z kannabinoidami może zwiększyć ich funkcjonalność medyczną. Ten przegląd podkreśla znaczenie zrozumienia chemii terpenów w konopiach indyjskich i zapewnia opisowe kategorie profili różnych komercyjnych odmian konopi.
BIBLIOGRAFIA
- Cheng, C.; Zang, G.; Zhao, L.; Gao, C.; Tang, Q.; Chen, J.; Guo, X.; Peng, D.; Su, J. A rapid shoot regeneration protocol from the cotyledons of hemp (Cannabis sativa L.). Ind. Crop. Prod. 2016, 83, 61–65. [Google Scholar] [CrossRef]
- Weinberger, A.H.; Zhu, J.; Levin, J.; Barrington-Trimis, J.L.; Copeland, J.; Wyka, K.; Kim, J.H.; Goodwin, R.D. Cannabis use among US adults with anxiety from 2008 to 2017: The role of state-level cannabis legalization. Drug Alcohol Depend. 2020, 214, 108163. [Google Scholar] [CrossRef] [PubMed]
- Rabiee, R.; Lundin, A.; Agardh, E.; Hensing, G.; Allebeck, P.; Danielsson, A.-K. Cannabis use and the risk of anxiety and depression in women: A comparison of three Swedish cohorts. Drug Alcohol Depend. 2020, 216, 108332. [Google Scholar] [CrossRef] [PubMed]
- Lloyd, S.L.; Lopez-Quintero, C.; Striley, C.W. Sex differences in driving under the influence of cannabis: The role of medical and recreational cannabis use. Addict. Behav. 2020, 110, 106525. [Google Scholar] [CrossRef] [PubMed]
- Turna, J.; Balodis, I.; Munn, C.; Van Ameringen, M.; Busse, J.; MacKillop, J. Overlapping patterns of recreational and medical cannabis use in a large community sample of cannabis users. Compr. Psychiatry 2020, 102, 152188. [Google Scholar] [CrossRef] [PubMed]
- Theparat, C. New Rule Makes It Legal to Grow Hemp. Available online: https://www.bangkokpost.com/thailand/general/1845714/new-rule-makes-it-legal-to-grow-hemp (accessed on 2 October 2020).
- Koltai, H.; Namdar, D. Cannabis Phytomolecule ‘Entourage’: From Domestication to Medical Use. Trends Plant Sci. 2020, 25, 976. [Google Scholar] [CrossRef] [PubMed]
- Booth, J.K.; Bohlmann, J. Terpenes in Cannabis sativa—From plant genome to humans. Plant Sci. 2019, 284, 67. [Google Scholar] [CrossRef]
- Clarke, R.; Merlin, M.D. History of Cannabis Use for Fiber. In Cannabis; University of California Press: Berkeley, CA, USA, 2019. [Google Scholar]
- Fleming, M.; Clarke, R. Physical evidence for the antiquity of Cannabis sativa L. J. Int. Hemp Assoc. 1998, 5, 80–95. [Google Scholar]
- Li, H.-L. An archaeological and historical account of cannabis in China. Econ. Bot. 1973, 28, 437–448. [Google Scholar] [CrossRef]
- Li, H.-L. The origin and use of cannabis in Eastern Asia linguistic-cultural implications. Econ. Bot. 1974, 28, 293–301. [Google Scholar] [CrossRef]
- Hillig, K.W. A chemotaxonomic analysis of terpenoid variation in Cannabis. Biochem. Syst. Ecol. 2004, 32, 875–891. [Google Scholar] [CrossRef]
- Aluko, R.E. Chapter 7—Hemp Seed (Cannabis sativa L.) Proteins: Composition, Structure, Enzymatic Modification, and Functional or Bioactive Properties. In Sustainable Protein Sources; Nadathur, S.R., Wanasundara, J.P.D., Scanlin, L., Eds.; Academic Press: San Diego, CA, USA, 2017. [Google Scholar] [CrossRef]
- Abel, E.L. Cannabis in the Ancient World. In Marihuana; Springer: Berlin/Heidelberg, Germany, 1980; pp. 3–35. [Google Scholar]
- Bonini, S.A.; Premoli, M.; Tambaro, S.; Kumar, A.; Maccarinelli, G.; Memo, M.; Mastinu, A. Cannabis sativa: A comprehensive ethnopharmacological review of a medicinal plant with a long history. J. Ethnopharmacol. 2018, 227, 300. [Google Scholar] [CrossRef] [PubMed]
- Mediavilla, V.; Leupin, M.; Keller, A. Influence of the growth stage of industrial hemp on the yield formation in relation to certain fibre quality traits. Ind. Crop. Prod. 2001, 13, 49–56. [Google Scholar] [CrossRef]
- Cosentino, S.L.; Riggi, E.; Testa, G.; Scordia, D.; Copani, V. Evaluation of European developed fibre hemp genotypes (Cannabis sativa L.) in semi-arid Mediterranean environment. Ind. Crop. Prod. 2013, 50, 312–324. [Google Scholar] [CrossRef]
- Bewley-Taylor, D.; Blickman, T.; Jelsma, M. The Rise and Decline of Cannabis Prohibition, the History of Cannabis in the UN Drug Control System and Options for Reform; Transnational Institute (TNI): Amsterdam, The Netherlands, 2014. [Google Scholar]
- Gaoni, Y.; Mechoulam, R. Isolation, structure, and partial synthesis of an active constituent of Hashish. J. Am. Chem. Soc. 1964, 86, 1646–1647. [Google Scholar] [CrossRef]
- Mudr, P.; Et, S.; Facultatis, M. Compounds. In Acta Universitatis Palackianae Olomucensis-TOM.35; Facultatis, M., Ed.; Palacký University Olomouc: Olomouc, Czech Republic, 1964. [Google Scholar]
- Adams, R.; Pease, D.C.; Cain, C.K.; Baker, B.R.; Clark, J.H.; Wolff, H.; Wearn, R.B. Conversion of cannabidiol to a product with marihuana activity. A type reaction for synthesis of analogous substances. conversion of cannabidiol to cannabinol. J. Am. Chem. Soc. 1940, 62, 2245–2246. [Google Scholar] [CrossRef]
- Devane, W.A.; Dysarz, F.A., 3rd; Johnson, M.R.; Melvin, L.S.; Howlett, A.C. Determination and characterization of a cannabinoid receptor in rat brain. Mol. Pharmacol. 1988, 34, 605–613. [Google Scholar] [PubMed]
- Devane, A.W.; Hanus, L.; Breuer, A.; Pertwee, R.G.; Stevenson, A.L.; Griffin, G.; Gibson, D.; Mandelbaum, A.; Etinger, A.; Mechoulam, R. Isolation and structure of a brain constituent that binds to the cannabinoid receptor. Science 1992, 258, 1946–1949. [Google Scholar] [CrossRef]
- Simonsen, J.L.; Todd, A.R. 32. Cannabis indica. Part X. The essential oil from Egyptian hashish. J. Chem. Soc. 1942, 10, 188. [Google Scholar] [CrossRef]
- Hanuš, L.O.; Hod, Y. Terpenes/Terpenoids in Cannabis: Are They Important? Med. Cannabis Cannabinoids 2020, 3, 25–60. [Google Scholar] [CrossRef]
- Ben-Shabat, S.; Fride, E.; Sheskin, T.; Tamiri, T.; Rhee, M.-H.; Vogel, Z.; Bisogno, T.; De Petrocellis, L.; Di Marzo, V.; Mechoulam, R. An entourage effect: Inactive endogenous fatty acid glycerol esters enhance 2-arachidonoyl-glycerol cannabinoid activity. Eur. J. Pharmacol. 1998, 353, 23–31. [Google Scholar] [CrossRef]
- Russo, E.B. Taming THC: Potential cannabis synergy and phytocannabinoid-terpenoid entourage effects. Br. J. Pharmacol. 2011, 163, 1344–1364. [Google Scholar] [CrossRef]
- Gallily, R.; Yekhtin, Z.; Hanuš, L.O. The Anti-Inflammatory Properties of Terpenoids from Cannabis. Cannabis Cannabinoid Res. 2018, 3, 282. [Google Scholar] [CrossRef] [PubMed]
- Baron, E.P. Medicinal properties of cannabinoids, terpenes, and flavonoids in cannabis, and benefits in migraine, headache, and pain: An update on current evidence and cannabis science. Headache J. Head Face Pain 2018, 58, 1139. [Google Scholar] [CrossRef] [PubMed]
- Lewis, M.A.; Russo, E.B.; Smith, K.M. Pharmacological foundations of cannabis chemovars. Planta Med. 2017, 84, 225. [Google Scholar] [CrossRef] [PubMed]
- Horne, M.R.L. 5B-Bast fibres: Hemp cultivation and production. In Handbook of Natural Fibres, 2nd ed.; Kozłowski, R.M., Mackiewicz-Talarczyk, M., Eds.; Woodhead Publishing: Cambridge, UK, 2020. [Google Scholar] [CrossRef]
- Réquilé, S.; Le Duigou, A.; Bourmaud, A.; Baley, C. Peeling experiments for hemp retting characterization targeting biocomposites. Ind. Crop. Prod. 2018, 123, 573. [Google Scholar] [CrossRef]
- Anderson, L.C. Leaf variation among cannabis species from a controlled garden. Bot. Mus. Leafl. Harv. Univ. 1980, 28, 61–69. [Google Scholar]
- Schultes, R.E.; Klein, W.M.; Plowman, T.; Lockwood, T.E. 35. In Cannabis: An Example of Taxonomic Neglect; Walter de Gruyter GmbH: Berlin, Germany, 1975; Volume 23, pp. 21–38. [Google Scholar]
- Cai, C.; Yu, W.; Wang, C.; Liu, L.; Li, F.; Tan, Z. Green extraction of cannabidiol from industrial hemp (Cannabis sativa L.) using deep eutectic solvents coupled with further enrichment and recovery by macroporous resin. J. Mol. Liq. 2019, 287, 110957. [Google Scholar] [CrossRef]
- Wiebelhaus, N.; Hamblin, D.; Kreitals, N.M.; Almirall, J.R. Differentiation of marijuana headspace volatiles from other plants and hemp products using capillary microextraction of volatiles (CMV) coupled to gas-chromatography-mass spectrometry (GC-MS). Forensic Chem. 2016, 2, 1–8. [Google Scholar] [CrossRef]
- Hammond, C.T.; Mahlberg, P.G. Morphogenesis of capitate glandular hairs of Cannabis sativa (Cannabaceae). Am. J. Bot. 1977, 64, 1023–1031. [Google Scholar] [CrossRef]
- Potter, D. The Propagation, Characterisation and Optimisation of Cannabis sativa L. as a Phytopharmaceutical; King’s College London: London, UK, 2009. [Google Scholar]
- Livingston, S.J.; Quilichini, T.D.; Booth, J.K.; Wong, D.C.J.; Rensing, K.H.; Laflamme-Yonkman, J.; Castellarin, S.D.; Bohlmann, J.; Page, J.E.; Samuels, A.L. Cannabis glandular trichomes alter morphology and metabolite content during flower maturation. Plant J. 2019, 101, 37. [Google Scholar] [CrossRef] [PubMed]
- Gupta, A.K.; Jain, A.; Roy, P.; Singh, R. Pharmacological evaluation of Cannabis indica for their aphrodisiac potential. Int. J. Ayurvedic Med. 2020, 11, 399. [Google Scholar] [CrossRef]
- Ahmed, A.; Shapiro, D.; Su, J.; Nelson, L.P. Vaping Cannabis Butane Hash Oil Leads to Severe Acute Respiratory Distress Syndrome—A case of EVALI in a teenager with hypertrophic cardiomyopathy. J. Intensiv. Care Med. 2020. [Google Scholar] [CrossRef] [PubMed]
- Stephens, D.; Patel, J.K.; Angelo, D.; Frunzi, J. Cannabis butane hash oil dabbing induced lung injury mimicking atypical pneumonia. Cureus 2020, 12, e7033. [Google Scholar] [CrossRef] [PubMed]
- Schwachtje, J.; Baldwin, I.T. Why does herbivore attack reconfigure primary metabolism? Plant Physiol. 2008, 146, 845–851. [Google Scholar] [CrossRef] [PubMed]
- Sommano, S. Effect of Food Processing on Bioactive Compounds. In Advances in Food Science and Nutrition, 2nd ed.; Visakh, M.P., Iturriaga, L.B., Ribotta, P.D., Eds.; Scrivener Publishing LLC: Beverly, MA, USA, 2013; pp. 361–390. [Google Scholar] [CrossRef]
- Sommano, S.R.; Caffin, N.; Kerven, G. Screening for antioxidant activity, phenolic content, and flavonoids from Australian native food plants. Int. J. Food Prop. 2012, 16, 1394–1406. [Google Scholar] [CrossRef]
- Sunanta, P.; Chung, H.-H.; Kunasakdakul, K.; Ruksiriwanich, W.; Jantrawut, P.; Hongsibsong, S.; Sommano, S.R. Genomic relationship and physiochemical properties among raw materials used for Thai black garlic processing. Food Sci. Nutr. 2020, 8, 4534–4545. [Google Scholar] [CrossRef]
- Wisetkomolmat, J.; Suppakittpaisarn, P.; Sommano, S.R. Detergent plants of northern Thailand: Potential sources of natural saponins. Resources 2019, 8, 10. [Google Scholar] [CrossRef]
- Tangpao, T.; Chung, H.-H.; Sommano, S.R. Aromatic profiles of essential oils from five commonly used Thai basils. Foods 2018, 7, 175. [Google Scholar] [CrossRef]
- Ross, S.A.; ElSohly, M.A. The volatile oil composition of fresh and air-dried buds of Cannabis sativa. J. Nat. Prod. 1996, 59, 49–51. [Google Scholar] [CrossRef]
- Turner, C.E.; ElSohly, M.A.; Boeren, E.G. Constituents of Cannabis sativa L. XVII. A review of the natural constituents. J. Nat. Prod. 1980, 43, 169–234. [Google Scholar] [CrossRef] [PubMed]
- Wanas, A.S.; Radwan, M.M.; Chandra, S.; Lata, H.; Mehmedic, Z.; Ali, A.; Baser, K.; Demirci, B.; ElSohly, M.A. Chemical composition of volatile oils of fresh and air-dried buds of cannabis chemovars, their insecticidal and repellent activities. Nat. Prod. Commun. 2020, 15, 1934578X20926729. [Google Scholar] [CrossRef]
- Rice, S.; Koziel, J.A. Characterizing the smell of marijuana by odor impact of volatile compounds: An application of simultaneous chemical and sensory analysis. PLoS ONE 2015, 10, e0144160. [Google Scholar] [CrossRef]
- Ternelli, M.; Brighenti, V.; Anceschi, L.; Poto, M.; Bertelli, D.; Licata, M.; Pellati, F. Innovative methods for the preparation of medical cannabis oils with a high content of both cannabinoids and terpenes. J. Pharm. Biomed. Anal. 2020, 186, 113296. [Google Scholar] [CrossRef] [PubMed]
- Wang, C.-T.; Ashworth, K.; Wiedinmyer, C.; Ortega, J.; Harley, P.C.; Rasool, Q.Z.; Vizuete, W. Ambient measurements of monoterpenes near Cannabis cultivation facilities in Denver, Colorado. Atmos. Environ. 2020, 232, 117510. [Google Scholar] [CrossRef]
- Abdollahi, M.; Sefidkon, F.; Calagari, M.; Mousavi, A.; Mahomoodally, M.F. Impact of four hemp (Cannabis sativa L.) varieties and stage of plant growth on yield and composition of essential oils. Ind. Crop. Prod. 2020, 155, 112793. [Google Scholar] [CrossRef]
- Sriwichai, T.; Junmahasathien, T.; Sookwong, P.; Potapohn, N.; Sommano, S.R. Evaluation of the optimum harvesting maturity of makhwaen fruit for the perfumery industry. Agriculture 2019, 9, 78. [Google Scholar] [CrossRef]
- Booth, J.K.; Page, J.E.; Bohlmann, J. Terpene synthases from Cannabis sativa. PLoS ONE 2017, 12, e0173911. [Google Scholar] [CrossRef]
- Nagegowda, D.A.; Gupta, P. Advances in biosynthesis, regulation, and metabolic engineering of plant specialized terpenoids. Plant Sci. 2020, 294, 110457. [Google Scholar] [CrossRef]
- Chen, F.; Tholl, D.; Bohlmann, J.; Pichersky, E. The family of terpene synthases in plants: A mid-size family of genes for specialized metabolism that is highly diversified throughout the kingdom. Plant J. 2011, 66, 212–229. [Google Scholar] [CrossRef]
- Fellermeier, M.; Eisenreich, W.; Bacher, A.; Zenk, M.H. Biosynthesis of cannabinoids Incorporation experiments with 13C-labeled glucoses. JBIC J. Biol. Inorg. Chem. 2001, 268, 1596–1604. [Google Scholar] [CrossRef] [PubMed]
- Aliferis, K.A.; Bernard-Perron, D. Cannabinomics: Application of metabolomics in cannabis (Cannabis sativa L.) research and development. Front. Plant Sci. 2020, 11, 11. [Google Scholar] [CrossRef] [PubMed]
- Masoud, A.N.; Doorenbos, N.J. Mississippi-Grown Cannabis sativa L. III: Cannabinoid and cannabinoid acid content. J. Pharm. Sci. 1973, 62, 313–315. [Google Scholar] [CrossRef]
- Grijó, D.R.; Osorio, I.A.V.; Cardozo-Filho, L. Supercritical extraction strategies using CO2 and ethanol to obtain cannabinoid compounds from Cannabis hybrid flowers. J. CO2 Util. 2018, 28, 174. [Google Scholar] [CrossRef]
- Miyazawa, M.; Yamafuji, C. Inhibition of acetylcholinesterase activity by bicyclic monoterpenoids. J. Agric. Food Chem. 2005, 53, 1765–1768. [Google Scholar] [CrossRef] [PubMed]
- Gaggiotti, S.; Palmieri, S.; Pelle, F.D.; Sergi, M.; Cichelli, A.; Mascini, M.; Compagnone, D. Piezoelectric peptide-hpDNA based electronic nose for the detection of terpenes; Evaluation of the aroma profile in different Cannabis sativa L. (hemp) samples. Sens. Actuators B Chem. 2020, 308, 127697. [Google Scholar] [CrossRef]
- Sriwichai, T.; Sookwong, P.; Siddiqui, M.W.; Sommano, S.R. Aromatic profiling of Zanthoxylum myriacanthum (makwhaen) essential oils from dried fruits using different initial drying techniques. Ind. Crop. Prod. 2019, 133, 284. [Google Scholar] [CrossRef]
- Maayah, Z.H.; Takahara, S.; Ferdaoussi, M.; Dyck, J.R. The molecular mechanisms that underpin the biological benefits of full-spectrum cannabis extract in the treatment of neuropathic pain and inflammation. Biochim. Biophys. Acta (BBA) Mol. Basis Dis. 2020, 1866, 165771. [Google Scholar] [CrossRef]
- Rao, V.S.N.; Menezes, A.M.S.; Viana, G.S.B. Effect of myrcene on nociception in mice. J. Pharm. Pharmacol. 1990, 42, 877–878. [Google Scholar] [CrossRef]
- Meschler, J. Thujone exhibits low affinity for cannabinoid receptors but fails to evoke cannabimimetic responses. Pharmacol. Biochem. Behav. 1999, 62, 473–480. [Google Scholar] [CrossRef]
- Gilbert, A.N.; DiVerdi, J.A. Consumer perceptions of strain differences in Cannabis aroma. PLoS ONE 2018, 13, e0192247. [Google Scholar] [CrossRef] [PubMed]
- Brenneisen, R. Chemistry and Analysis of Phytocannabinoids and Other Cannabis Constituents. In Marijuana and the Cannabinoids; ElSohly, M.A., Ed.; Humana Press: Totowa, NJ, USA, 2007. [Google Scholar] [CrossRef]
- Fischedick, J.T.; Hazekamp, A.; Erkelens, T.; Choi, Y.H.; Verpoorte, R. Metabolic fingerprinting of Cannabis sativa L., cannabinoids and terpenoids for chemotaxonomic and drug standardization purposes. Phytochemistry 2010, 71, 2058–2073. [Google Scholar] [CrossRef] [PubMed]
- Brown, A.K.; Xia, Z.; Bulloch, P.; Idowu, I.; Francisco, O.; Stetefeld, J.; Stout, J.; Zimmer, J.; Marvin, C.; Letcher, R.J.; et al. Validated quantitative cannabis profiling for Canadian regulatory compliance—Cannabinoids, aflatoxins, and terpenes. Anal. Chim. Acta 2019, 1088, 79. [Google Scholar] [CrossRef] [PubMed]
- Shapira, A.; Berman, P.; Futoran, K.; Guberman, O.; Meiri, D. Tandem Mass Spectrometric Quantification of 93 terpenoids in cannabis using static headspace injections. Anal. Chem. 2019, 91, 11425. [Google Scholar] [CrossRef]
- Rice, S.; Koziel, J.A. The relationship between chemical concentration and odor activity value explains the inconsistency in making a comprehensive surrogate scent training tool representative of illicit drugs. Forensic Sci. Int. 2015, 257, 257–270. [Google Scholar] [CrossRef]
- Kabir, A.; Holness, H.; Furton, K.G.; Almirall, J.R. Recent advances in micro-sample preparation with forensic applications. TrAC Trends Anal. Chem. 2013, 45, 264–279. [Google Scholar] [CrossRef]
- Calvi, L.; Pentimalli, D.; Panseri, S.; Giupponi, L.; Gelmini, F.; Beretta, G.; Vitali, D.; Bruno, M.; Zilio, E.; Pavlovic, R.; et al. Comprehensive quality evaluation of medical Cannabis sativa L. inflorescence and macerated oils based on HS-SPME coupled to GC–MS and LC-HRMS (q-exactive orbitrap®) approach. J. Pharm. Biomed. Anal. 2018, 150, 208. [Google Scholar] [CrossRef]
- Koltai, H.; Poulin, P.; Namdar, D. Promoting cannabis products to pharmaceutical drugs. Eur. J. Pharm. Sci. 2019, 132, 118. [Google Scholar] [CrossRef]
- Koby, M. How Terpenes Could Revolutionize the Cannabis Industry as We Know It in Innovators; Entrepreneur Media, Inc.: Irvine, CA, USA, 2020. [Google Scholar]
- King, J.W. The relationship between cannabis/hemp use in foods and processing methodology. Curr. Opin. Food Sci. 2019, 28, 32. [Google Scholar] [CrossRef]
- Charlebois, S.; Somogyi, S.; Sterling, B. Cannabis-infused food and Canadian consumers’ willingness to consider “recreational” cannabis as a food ingredient. Trends Food Sci. Technol. 2018, 74, 112. [Google Scholar] [CrossRef]
- Khan, R.S.; Grigor, J.V.; Winger, R.; Win, A. Functional food product development—Opportunities and challenges for food manufacturers. Trends Food Sci. Technol. 2013, 30, 27–37. [Google Scholar] [CrossRef]
- Benelli, G.; Pavela, R.; Petrelli, R.; Cappellacci, L.; Santini, G.; Fiorini, D.; Sut, S.; Dall’Acqua, S.; Canale, A.; Maggi, F. The essential oil from industrial hemp (Cannabis sativa L.) by-products as an effective tool for insect pest management in organic crops. Ind. Crop. Prod. 2018, 122, 308. [Google Scholar] [CrossRef]
- Hanif, M.A.; Nawaz, H.; Naz, S.; Mukhtar, R.; Rashid, N.; Bhatti, I.A.; Saleem, M. Raman spectroscopy for the characterization of different fractions of hemp essential oil extracted at 130 °C using steam distillation method. Spectrochim. Acta Part A Mol. Biomol. Spectrosc. 2017, 182, 168. [Google Scholar] [CrossRef] [PubMed]
- Fiorini, D.; Scortichini, S.; Bonacucina, G.; Greco, N.G.; Mazzara, E.; Petrelli, R.; Torresi, J.; Maggi, F.; Cespi, M. Cannabidiol-enriched hemp essential oil obtained by an optimized microwave-assisted extraction using a central composite design. Ind. Crop. Prod. 2020, 154, 112688. [Google Scholar] [CrossRef]
- Blake, A.; Nahtigal, I. The evolving landscape of cannabis edibles. Curr. Opin. Food Sci. 2019, 28, 25. [Google Scholar] [CrossRef]
- Baldino, L.; Scognamiglio, M.; Reverchon, E. Supercritical fluid technologies applied to the extraction of compounds of industrial interest from Cannabis sativa L. and to their pharmaceutical formulations: A review. J. Supercrit. Fluids 2020, 165, 104960. [Google Scholar] [CrossRef]
- Naz, S.; Hanif, M.A.; Bhatti, H.N.; Ansari, T.M. Impact of supercritical fluid extraction and traditional distillation on the isolation of aromatic compounds from Cannabis indica and Cannabis sativa. J. Essent. Oil Bear. Plants 2017, 20, 175. [Google Scholar] [CrossRef]
Więcej informacji na temat badania w PDF
Źródłó: MDPI
Nasze autorskie olejki eteryczne, zawierające terpeny z konopi indyjskich dostępne są u nas w sklepie.
- Wpływ marihuany na zdrowie: badania układu sercowo-naczyniowego - 26 czerwca 2025
- Hop Latent Viroid (HpLVd) czyli Utajony Wiroid Chmielu: Co wiemy? - 23 czerwca 2025
- „Tysiąc jointów później” – co naprawdę dzieje się z mózgiem stałego palacza marihuany? - 19 czerwca 2025